来源:admin 2019-03-15 14:36:12
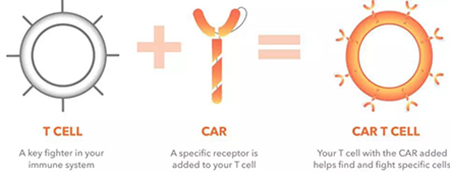
在2017年8月,美国FDA批准嵌合抗原受体转移(CAR-T)-Kymriah-用于治疗急性淋巴细胞白血病(ALL)。收集病人T细胞进行重编程以表达靶向特定肿瘤的特异性CARs,使T细胞具有抗肿瘤的细胞毒潜能。在化疗清除淋巴细胞后,经改造的T细胞回输到病人体内。
在63例患有复发或难治性前体B细胞急性淋巴细胞白血病(ALL)的小儿和青年患者的多中心临床试验中,Kymriah治疗3个月内缓解率为83%。
抗体和双特异性抗体
单克隆抗体具有高度特异性。经广泛优化后,第一个抗肿瘤单抗利妥昔于1997年批准上市。FDA已批准44种用于各种疾病的单克隆抗体。单抗已成为治疗肿瘤的主要手段。然而,这些分子尚无能力作为单药治愈肿瘤,且有报道称,它们会产生耐药性或对治疗不能产生反应。肿瘤是涉及许多信号通路多因素疾病,这限制了单抗单独起作用的能力。
因此,多靶向的双体异性抗体(BsAbs)可能更有效。它们可通过重定向特异性免疫细胞到肿瘤细胞增强肿瘤杀伤能力,能够阻断在发病机制中发挥重叠作用的两种不同途径,而通过与两种不同的细胞表面抗原结合而具有更好的结合特异性。目前,有30多个双特异性抗体处于临床开发阶段,而catumaxomab和blinatumomab已经获批。
免疫检查点阻断
免疫检查点是抑制性通路,维持自身耐受,通过调节免疫应答强度和持续时间,保证组织损伤最小化的。肿瘤利用这些免疫检查点获得免疫耐受,尤其是对肿瘤抗原的特异性T细胞。因此,免疫检查点阻断是免疫疗法的一种很有前途的手段。
活化的T细胞表达多种共抑制受体,如淋巴细胞活化基因3 (LAG3)、程序性细胞死亡蛋白1 (PD-1)、细胞毒性T淋巴细胞相关蛋白4 (CTLA-4)和迟发相关肽(LAP)。多数免疫检查点都涉及配体-受体相互作用,因此重组配体或受体和抗体可以阻断它们。CTLA-4抗体是美国FDA批准的第一类免疫治疗药物。
靶向CTLA-4免疫检查点
CTLA-4是临床上第一个靶向免疫检查点,仅表达于T细胞,并在早期调节T细胞活化的幅度。它抑制T细胞共刺激受体CD28的活性。识别抗原后,CD28信号放大TCR信号而活化T细胞。CTLA-4和CD28具有相同配体CD80/CD86。CTLA-4可阻止CD28与CD80和CD86的接合,以及主动清除APC表面CD80和CD86,由此产生不依赖信号的T细胞抑制作用。
CTLA-4敲除小鼠的致死性全身免疫过活化表型显示了CTLA-4在T细胞活化中的作用。CTLA-4阻断可导致T细胞依赖性免疫刺激,反之,CTLA4在Treg细胞上表达可激活其抑制功能。虽然,CTLA4介导的Treg细胞免疫抑制机制尚不清楚,阻断Treg细胞特异性的CTLA-4明显抑制肿瘤和自身免疫调节。
因此,CTLA-4阻断作用机制是增强CD4活性和抑制Treg依赖性免疫抑制的重要因素。CTLA-4阻断可增强内源性应答。在免疫原性较差的肿瘤中,将CTLA-4与粒细胞-巨噬细胞集落刺激因子(GM-CSF)转导的细胞疫苗联合使用,可诱导强免疫应答以减小或消除肿瘤。基于这些发现,FDA批准了两种CTLA-4抗体,ipilimumab和tremelimumab。
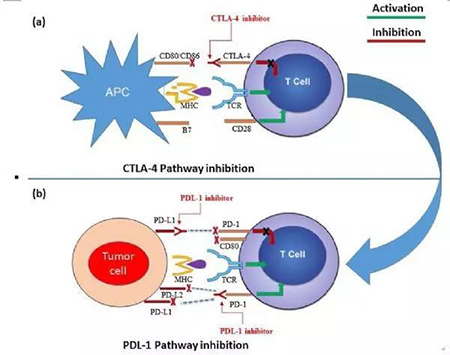
靶向PD-1的免疫检查点
不同于CTLA-4,炎症反应时,PD-1限制外周组织中T细胞活化。T细胞活化诱导PD-1表达,是肿瘤微环境中主要免疫抑制机制。PD-1通过磷酸酶SHP2抑制配体结合时T细胞活化涉及的激酶。PD-1在Treg细胞上高表达,且在配体结合后增强细胞增殖。肿瘤被Treg细胞高度浸润,进而导致免疫反应的抑制。因此,阻断PD-1通路可增强抗肿瘤免疫反应。
PDL1和PDL2是PD1的配体。在PD-1缺陷T细胞中,PDL1和PDL2结合T细胞上的共刺激受体,就如同CD80和CD86配体对,每一个均可与静息T细胞上表达的CD28以及表达在活化的T细胞上CTLA-4结合。然而,PD-1主要调节组织或肿瘤内的效应T细胞活性,CTLA-4主要调节T细胞活化。重要的是要理解在不同肿瘤环境中抗体和配体相互作用的功能,以供临床选择。
与CTLA-4抗体相比,PD-1抗体的临床经验非常有限。人IgG4 PD-1抗体的I期临床试验中,部分病例肿瘤消退,从部分缓解到混合缓解再到完全缓解。PD-1或PDL-1靶向抗体正在进行临床试验。PD-1配体相互作用表明,PD-1抗体可能具有不同于PDL-1抗体的生物学活性。